

Apa yang Sedulur ketahui tentang atom? Ya, atom adalah satuan dasar materi yang terdiri dari proton, neutron, dan elektron. Ketiga partikel yang telah disebutkan itulah yang menyusun struktur atom. Secara mudahnya, atom adalah partikel terkecil yang sudah tidak bisa dibagi lagi.
Dalam perkembangan ilmu pengetahuan yang membahas tentang atom, banyak teori dari para ahli yang bermunculan. Para tokoh tersebut membuat penelitian untuk mempelajari seluk beluk dan apapun yang ada pada sebuah atom. Sebab itulah, kita bisa mendapatkan informasi seputar atom hingga saat ini. Agar pengetahuan Sedulur mengenai struktur atom semakin bertambah, cobalah simak informasi tentang perkembangan teori atom dan siapa saja tokoh dibaliknya berikut ini.
BACA JUGA: Energi Potensial adalah: Pengertian, Jenis dan Rumusnya
Struktur atom adalah
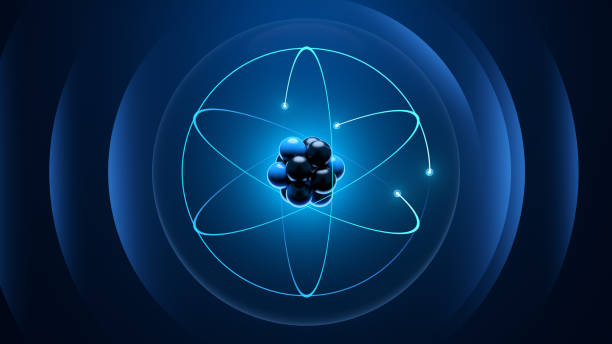

Struktur atom adalah satuan dasar materi yang terdiri dari inti atom dan muatan negatif dari elektron yang mengelilinginya. Di dalam inti dari setiap atom, terdapat dua campuran yang terdiri dari proton dengan muatan positif dan neutron dengan muatan netral.
Struktur atom juga bisa didefinisikan sebagai susunan partikel dasar atom. Partikel dasar bernama elektron yang mengelilingi inti atom dapat terikat kuat karena adanya gaya elektromagnetik. Gaya ini jugalah yang membuat sekumpulan atom saling terikat hingga akhirnya membentuk suatu molekul.
Dari penjelasan tersebut, dapat disimpulkan bahwa teori atom akan selalu berhubungan dengan adanya gaya elektromagnetik. Meskipun kita mengira saat ini informasi mengenai atom sudah cukup jelas, tapi ternyata belum ada teori atau model yang mutlak dari sebuah atom. Hal ini karena teori atom masih mengalami perkembangan dan penyempurnaan dari waktu ke waktu.
Partikel dalam struktur atom
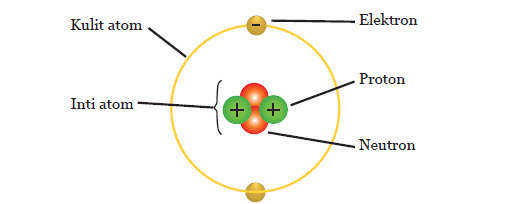

Walaupun dapat didefinisikan sebagai bagian terkecil yang sudah tidak bisa dibagi lagi, namun atom ternyata masih disusun oleh beberapa partikel penyusun atom atau yang dikenal sebagai partikel sub-atomik. Partikel ini terdiri dari proton, elektron, dan neutron.
Agar lebih paham, berikut adalah penjelasan mengenai partikel sub-atomik tersebut.
1. Proton
Proton ditemukan oleh seorang ilmuwan bernama Eugene Goldstein pada tahun 1886 melalui percobaan sinar katode yang telah dimodifikasi. Dalam percobaan tersebut, Goldstein memberi lubang atau saluran di tengah katode yang digunakan.
Setelah melakukan percobaan pada berbagai gas, Goldstein akhirnya menemukan bahwa gas hidrogen dapat menghasilkan sinar yang bermuatan positif paling kecil, baik dari segi massanya maupun muatan-muatannya, dengan begitu, partikel tersebut dinamakan sebagai proton. Lebih lanjut, proton memiliki muatan +1 dengan massa 1 sma (satuan muatan atom).
2. Elektron
Elektron ditemukan oleh seorang ilmuwan bernama J.J Thomson pada tahun 1897 melalui percobaan sinar katode. Sementara muatan elektron, ditemukan oleh seorang ilmuwan bernama Robert Millikan melalui percobaan tetesan halus minyak.
Dari hasil percobaan kedua ilmuwan tersebut, didapatkan kesimpulan bahwa elektron memiliki muatan -1 dan massa sama dengan 0. Sehingga, elektron dilambangkan dengan -1.
3. Neutron
Neutron ditemukan oleh seorang ilmuwan bernama James Chadwick pada tahun 1932 melalui percobaan tembakan atom Berilium dengan sinar alfa. Dari percobaan tersebut, diketahui bahwa partikel yang menimbulkan radiasi berdaya tembus tinggi memiliki sifat netral. Dengan demikian, neutron dikatakan tidak bermuatan.
Selain itu, neutron juga memiliki massa yang hampir sama dengan proton, yaitu 1 sma. Karena partikel muatannya sama dengan 0 (nol), maka neutron dikatakan bersifat netral.
BACA JUGA: Campuran Heterogen adalah: Pengertian dan Contohnya
Perkembangan teori atom dan tokohnya
Secara teori, perkembangan teori atom mulai mulai dikembangkan untuk menyempurnakan teori-teori yang sudah ada sebelumnya. Hingga pada tahun 1800-an, mulai ditemukan penemuan baru yang terkait dengan teori atom yang baru.
Dikembangkan oleh tokoh yang berbeda-beda, berikut adalah perkembangan teori atom yang dapat Sedulur pelajari lebih lanjut.
1. Teori Atom Dalton (John Dalton)
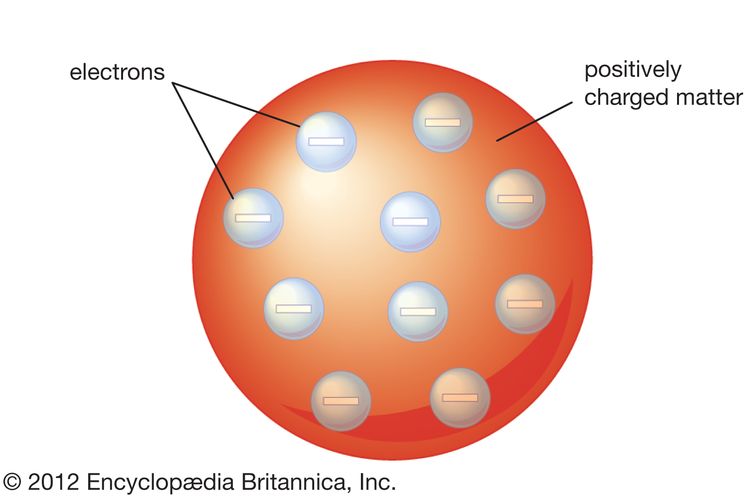

Perkembangan teori atom diawali oleh seorang tokoh bernama John Dalton yang menyatakan pendapatnya mengenai atom pada tahun 1803. Ia mendasarkan teorinya atas dua hukum, yakni Hukum Lavoisier (Hukum Kekekalan Massa) dan Hukum Proust (Hukum Susunan Tetap).
Isi dari teori atom Dalton, antara lain:
- Atom adalah bagian terkecil dari suatu unsur-unsur yang tidak dapat dibagi lagi.
- Atom-atom sejenis akan memiliki sifat yang sama, sedangkan atom-atom dengan unsur tidak sejenis akan memiliki sifat yang berbeda.
- Dalam reaksi kimia, akan terjadi penggabungan atau pemisahan atom.
- Atom dapat bergabung dengan atom lainnya sehingga membentuk molekul dengan perbandingan yang bulat dan sederhana.
Namun, dalam praktiknya, teori ini memiliki beberapa kekurangan, seperti:
- Atom unsur yang satu dengan atom unsur lainnya tidak bisa dideskripsikan dengan jelas.
- Gambaran tentang bagaimana cara atom saling bergabung tidak bisa dijelaskan.
- Hubungan senyawa antara larutan senyawa dengan daya hantar arus listrik juga tidak bisa dideskripsikan.
- Sifat listrik materi juga tidak bisa dideskripsikan.
Pada akhirnya, teori atom Dalton hanya bertahan selama 90 tahun karena pada tahun 1886, seorang ilmuwan bernama Eugene Goldstein telah menemukan partikel listrik bermuatan positif yang dikenal dengan nama proton. Setelahnya pun, pada tahun 1897, seorang ilmuwan bernama Thomson juga menemukan partikel bermuatan negatif yang dikenal sebagai elektron.
2. Teori Atom Thomson (Joseph John Thomson)
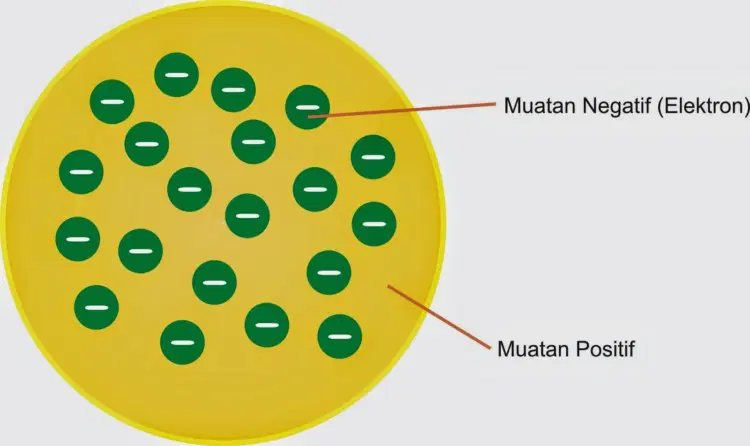

Telah disebutkan sebelumnya bahwa setelah teori atom Dalton, tokoh yang mempelopori perkembangan teori atom modern adalah Joseph John Thomson, atau sering dikenal sebagai teori atom Thomson.
Teori atom Thomson juga dikenal sebagai teori roti kismis karena muatan negatif (elektron) diibaratkan sebagai kismis yang mengelilingi atom bermuatan positif (proton) yang diibaratkan sebagai roti.
Isi dari teori atom Thomson, yaitu:
- Atom bukanlah bagian terkecil dari suatu zat.
- Massa elektron atom ternyata lebih kecil dari massa atom.
- Secara keseluruhan, atom bersifat netral karena muatan atom positif dan negatif yang ada pada atom adalah sama, dimana suatu atom tidak memiliki muatan positif dan negatif yang berlebihan.
- Atom dengan muatan positif akan tersebar secara merata di seluruh bagian atom, yang mana atom juga akan dinetralkan oleh elektron-elektron yang tersebar di antara muatan positif.
Namun, teori atom Thomson juga memiliki beberapa kekurangan, sebagai berikut.
- Tidak bisa menjelaskan bagaimana susunan muatan positif dan jumlah elektron yang ada di dalam bola.
- Tidak dapat menjelaskan tentang bagian inti atom.
3. Teori Atom Rutherford (Ernest Rutherford)
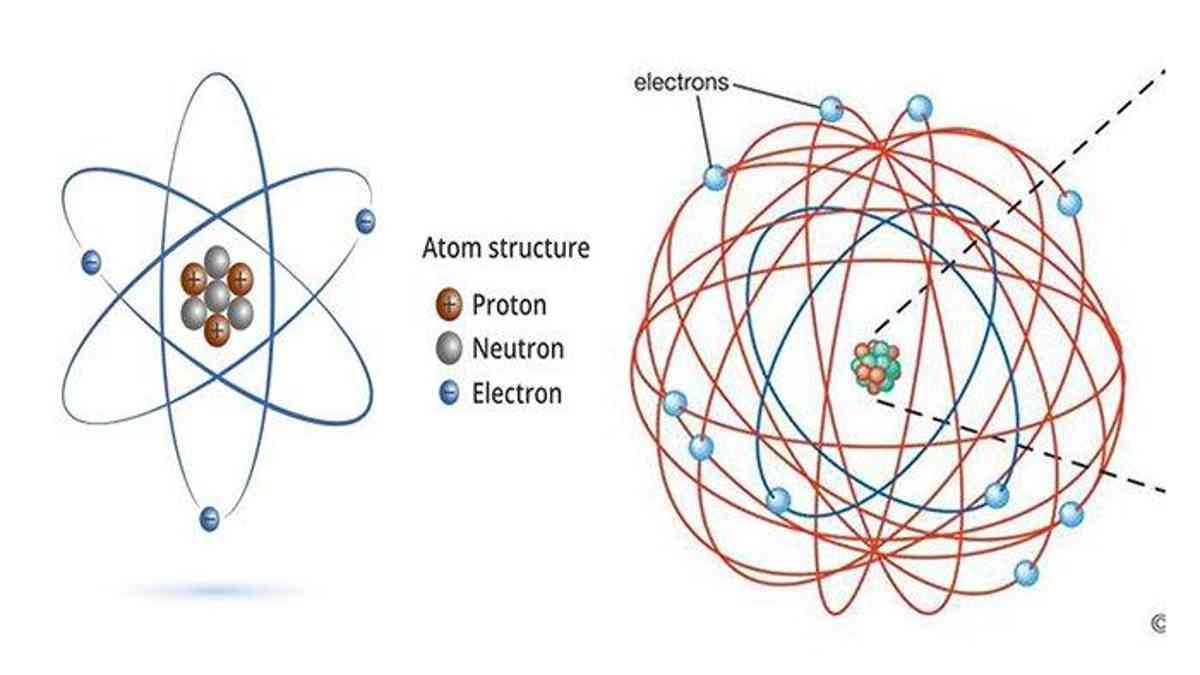

Berikutnya adalah teori atom yang dikembangkan oleh seorang ilmuwan bernama Ernest Rutherford. Teori ini berasal dari sebuah eksperimen penembakan inti atom pada lempengan emas dengan partikel alfa, yang dikenal sebagai eksperimen Geiger-Marsden.
Dari hasil percobaan tersebut, ditarik kesimpulan bahwa inti atom yang terkena partikel alfa akan menimbulkan terjadinya tumbukan yang menyebabkan pembelokan atau pemantulan partikel alfa. Diketahui juga bahwa penyebab terjadinya hal itu adalah massa dan muatan atom yang terpusat pada inti (nukleus).
Dengan demikian, Rutherford menyatakan bahwa muatan inti atom sama dengan massa atom dalam sma (satuan massa atom). Berikut adalah isi dari teori atom Rutherford.
- Atom terdiri atas inti atom yang bermuatan positif dan dikelilingi elektron-elektron yang bermuatan negatif seperti model tata surya.
- Atom bersifat netral karena muatan positif sebanding dengan muatan negatif.
- Selama mengitari inti, gaya sentripetal pada elektron akan terbentuk oleh gaya tarik menarik antara elektron dengan gaya inti atom (Gaya Coulomb).
- Sebagian besar volume atom adalah ruang kosong (bukan pejal) yang disebabkan oleh jari-jari inti atom yang jauh lebih kecil daripada jari-jari atom.
Sama seperti teori sebelumnya, teori atom Rutherford juga masih memiliki kekurangan, yaitu:
- Tidak bisa mendeskripsikan cara rotasi dari inti atom dan letak dari elektron.
- Tidak bisa mendeskripsikan spektrum garis yang ada pada atom hidrogen.
- Energi atom menjadi tidak stabil karena elektron yang bergerak akan memancarkan energi.
4. Teori Atom Bohr (Niels Bohr)
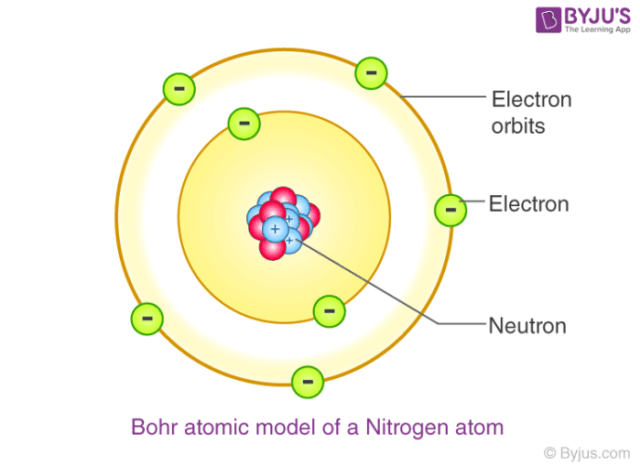

Perkembangan teori atom sampai pada seorang fisikawan asal Denmark bernama Niels Bohr. Teori atom Bohr ini berawal dari kelemahan teori atom Rutherford, yakni lintasan elektron yang disampaikan Rutherford belum bisa dianggap sempurna untuk menjelaskan struktur suatu atom karena dianggap bertentangan dengan teori elektrodinamika klasik Maxwell.
Bohr akhirnya berusaha mengembangkan dan memodifikasi agar teori atom Rutherford menjadi lebih sempurna dengan menggunakan model atom nuklir Rutherford dan teori kuantum Planck. Dari eksperimen tersebut, dihasilkan elektron-elektron yang mengelilingi inti atom, yang terdiri dari proton dan neutron dimana ada lintasan-lintasan tertentu yang disebut sebagai kulit elektron atau tingkat energi.
Berikut adalah inti dari teori atom Bohr, yaitu:
- Elektron mengelilingi atom pada orbit tertentu.
- Selama berada dalam lintasan, energi elektron akan tetap sehingga tidak ada energi yang diserap atau dipancarkan.
- Elektron hanya bisa berpindah dari satu kulit ke kulit lainnya dengan menyerap atau memancarkan energi.
- Lintasan-lintasan yang diperbolehkan elektron adalah lintasan-lintasan yang mempunyai momentum sudut dengan kelipatan bulat dari h2π (π=3,14).
Namun, teori atom Bohr juga memiliki beberapa kelemahan, diantaranya:
- Tidak dapat menerangkan spektrum atom yang lebih besar daripada hidrogen.
- Tidak bisa menjelaskan efek Zeeman.
5. Teori Atom Mekanika Kuantum (Werner Heisenberg dan Erwin Schrödinger)

Pada akhirnya, perkembangan teori atom sampai pada teori mekanika kuantum yang dikembangkan untuk menyempurnakan teori atom Bohr. Teori ini dilakukan oleh Erwin Schrödinger, seorang fisikawan dari Austria yang meraih Nobel Fisika pada tahun 1933.
Perkembangan teori atom modern ini didasarkan pada hipotesis de Broglie, yakni sifat dualisme pada elektron yang menjelaskan bahwa elektron bukan hanya sekadar partikel, namun juga sebagai gelombang. Jadi, elektron akan bergerak seperti gelombang dan juga memiliki lintasan yang juga merupakan gelombang.
Tidak hanya seorang diri, ada ilmuwan lain bernama Werner Heisenberg yang bekerja sama mengembangkan teori atom modern ini. Jika penelitianSchrödinger berdasarkan hipotesis de Broglie, maka penelitian Heisenberg didasarkan pada asas ketidakpastian Werner Heisenberg.
Dari asas ini, Heisenberg menyimpulkan bahwa terdapat suatu keterbatasan dalam menentukan posisi dan momentum elektron. Dengan begitu, dapat disimpulkan bahwa teori atom mekanika kuantum yang dicetuskan keduanya merupakan teori paling mutakhir dari beberapa teori atom sebelumnya.
BACA JUGA: Menyublim adalah: Pengertian, Proses dan Contoh Peristiwanya
Penulisan dan lambang atom


Setelah mempelajari perkembangan teori atom, penting juga untuk mengetahui bagaimana cara penulisan dan lambang atom. Hal ini karena gabungan dari partikel sub-atomik akan membentuk suatu unsur yang bervariasi. Agar lebih jelas, perhatikan ulasan berikut ini.
1. Nomor atom (Z)
Nomor atom (Z) merupakan jumlah proton (bermuatan positif) atau jumah elektron (bermuatan negatif) dalam suatu atom. Sebab atom bersifat netral, maka jumlah proton sama dengan jumlah elektronnya. Dengan begitu, nomor atom juga menunjukkan jumlah elektron yang nantinya juga menentukan sifat suatu unsur.
2. Nomor Massa (A)
Nomor massa (A) merupakan jumlah proton dan neutron. Nomor massa dari suatu unsur digunakan untuk menyatakan banyaknya proton dan neutron yang menyusun inti atom dari suatu unsur.
Jadi, Nomor Massa (A) = Jumlah Proton + Jumlah Neutron.
3. Lambang Unsur (X)
Lambang unsur (X) merupakan susunan dari suatu unsur netral, misalnya Oksigen memiliki lambang unsur (O).
Nah, dari penjelasan di atas, dapat disimpulkan bahwa nomor massa atau massa atom dari suatu unsur akan menyatakan banyaknya proton dan neutron. Sementara nomor atom akan menyatakan banyaknya jumlah proton. Namun, saat suatu unsur netral, maka nomor atomnya sama dengan elektron.
Perbedaan isotop, isobar, dan isoton
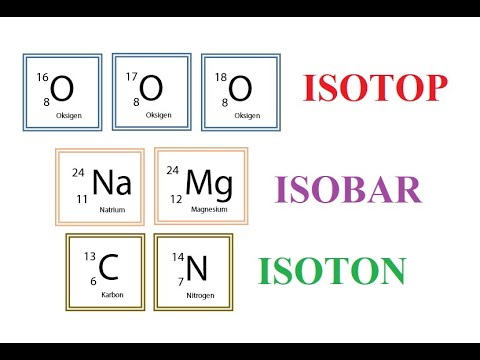

Selain pembahasan mengenai penulisan dan lambang atom, Sedulur juga perlu mengetahui informasi seputar isotop, isobar, dan isoton. Agar lebih mudah, silakan simak penjelasan berikut.
1. Isotop
Merupakan unsur-unsur yang memiliki nomor atom yang sama namun memiliki nomor massa berbeda. Contohnya adalah unsur Karbon (C) alam yang terdiri dari atas 2 jenis isotop yaitu dan .
2. Isobar
Merupakan unsur-unsur yang memiliki nomor massa yang sama namun memiliki nomor atom berbeda. Contohnya pada unsur Karbon dan Nitrogen, jadi dengan adalah isobar.
3. Isoton
Merupakan unsur-unsur yang memiliki nomor atom yang berbeda namun memiliki neutron yang sama. Contohnya pada unsur Karbon dan Nitrogen, jadi dengan adalah isoton karena keduanya memiliki neutron 7.
Konfigurasi elektron


Lebih lanjut, pembahasan mengenai konfigurasi elektron juga penting untuk diketahui. Konfigurasi elektron merupakan penyusunan atau lapisan elektron yang didasarkan pada tingkat energi dalam suatu atom.
Dalam hal ini, atom memiliki lapisan paling dekat dengan inti sampai yang terluar, yang secara berurutan dilambangkan dengan huruf K, L, M, N, O, P, Q, dan seterusnya. Disini, jumlah elektron maksimum pada suatu lapisan kulit haruslah memenuhi rumus , yang mana n = nomor kulit dan jumlah maksimum elektron yang ada pada kulit terluar adalah 8.
Lebih jelasnya, simak contoh berikut ini.
- Lapisan kulit K (n=1) akan memiliki nilai maksimum elektron = elektron.
- Lapisan kulit L (n=2) kan memiliki nilai maksimum elektron = elektron.
- Lapisan kulit M (n=3) kan memiliki nilai maksimum elektron = elektron .
Dan seterusnya.
Elektron valensi


Terakhir, pembahasan mengenai atom juga tak bisa dilepaskan dari adanya elektron valensi. Elektron valensi merupakan elektron yang ada pada kulit terluar dan berguna untuk membentuk ikatan kimia. Susunan dari elektron valensi ini akan sangat menentukan sifat-sifat kimia dari suatu atom. Jika unsur memiliki struktur elektron valensi yang sama, maka mereka juga akan memiliki sifat kimia yang sama.
Demikian informasi mengenai struktur atom beserta perkembangan teori dan tokoh-tokohnya. Semoga informasi ini dapat bermanfaat bagi Sedulur sekalian agar lebih memahami ilmu kimia, terutama atom dengan lebih baik lagi. Selamat belajar, ya!
Mau belanja bulanan nggak pakai ribet? Aplikasi Super solusinya! Mulai dari sembako hingga kebutuhan rumah tangga tersedia lengkap. Selain harganya murah, Sedulur juga bisa merasakan kemudahan belanja lewat handphone. Nggak perlu keluar rumah, belanjaan pun langsung diantar.
Bagi Sedulur yang punya toko kelontong atau warung, bisa juga lho belanja grosir atau kulakan lewat Aplikasi Super. Harga dijamin lebih murah dan bikin untung makin melimpah.





