Salah satu alat yang digunakan untuk membantu mempelajari unsur kimia adalah tabel periodik. Tabel ini berisi susunan unsu kimia yang tersusun berdasarkan nomor atom yang dimiliki. Tabel ini sangat berguna bagi siapapun yang sedang belajar ilmu kimia karena memberikan kemudahan saat menghafal.
Dalam tabel periodik terdapat beberapa istilah yang harus dipahami dengan baik. Istilah tersebut contohnya seperti periode, golongan, blok, jari-jari atom, dan nomor atom. Sedulur dapat mencari tahu berbagai tabel periodik suatu unsur kimia seperti uranium, emas, dan tembaga.
Meskipun bagi sebagian orang membaca tabel periodik adalah hal yang sulit, sebaiknya Sedulur tetap berusaha untuk mempelajarinya. Untuk membantu sedulur memahami tabel periodik dan namanya, berikut adalah artikel yang akan membahas mengenai tabel periodik beserta klasifikasi, sifat, dan cara membacanya.
BACA JUGA: Pengertian Senyawa Beserta Jenis dan Contohnya
Pengertian
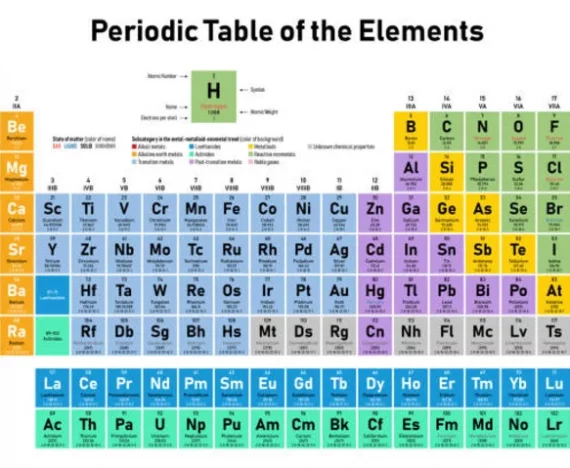
Tabel periodik merupakan berisi susunan unsur-unsur kimia berdasarkan nomor atom yang dimilikinya. Tabel ini terbagi menjadi empat blok, yaitu blok s, p, d, dan f. Tabel ini memiliki periode atau baris yang digunakan untuk menunjukkan sifat logam di bagian kiri dan sifat non logam pada bagian kanan.
Gambar di atas merupakan gambar tabel periodik unsur HD untuk memudahkan Sedulur dalam mempelajari materi ini.
Sejarah
Sejarah tabel periodik uranium dan senyawa lainnya diawali dengan pengelompokan unsur-unsur berdasarkan kemiripan sifatnya. Pengelompokan tersebut mengalami perkembangan dari yang paling sederhana hingga yang paling modern. Mulai dari Antoine Lavoisier hingga disempurnakan oleh Henry Moseley yang menemukan cara menentukan nomor atom.
Moseley melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar-X dan mendapatkan kesimpulan bahwa sifat dasar tidak didasari oleh massa atom relatif. Sifat ini didasari oleh kenaikan jumlah proton yang diakibatkan dari adanya isotop, atau unsur-unsur dengan massa atom berbeda, tetapi memiliki jumlah proton yang sama. Ikatan jumlah proton tersebut mencerminkan kenaikan nomor atom suatu unsur yang membuat sifat-sifat unsur menjadi fungsi periodik dari nomor atomnya.
Pengelompokan unsur kemudian disempurnakan menjadi sistem periodik modern dari hukum periodik Mendeleev yang dikenal sebagai tabel periodik bentuk panjang. Penyusunan tabel periodik emas ini didasarkan pada kenaikan atom dan kemiripan sifatnya.
Sistem periodik modern saat ini terdiri 7 periode, yang terbagi menjadi 2 jenis, yakni periode panjang (4,5,6, dan 7) dan periode pendek (1, 2, dan 3). Jumlah golongan pada sistem periodik juga terdiri atas 8 golongan utama (golongan A) dan 8 golongan tambahan (golongan B) atau unsur transisi yang terletak di antara golongan IIA dan IIIA.
BACA JUGA: Pengertian Molekul Unsur Beserta Ciri-ciri dan Contohnya
Fungsi

Tabel periodik tembaga dan unsur lainnya tentunya memiliki fungsi yang sangat penting dalam perkembangan ilmu kimia. Hal ini diketahui dari para ilmuwan yang menggunakan tabel periodik untuk lebih cepat merujuk pada informasi tentang suatu unsur seperti massa atom dan simbol kimia.
Fungsi lain dari tabel ini juga terdapat pada susunannya yang memungkinkan para ilmuwan untuk membedakan sifat unsur. Seperti elektronegativitas, energi ionisasi, dan jari-jari atom.
Klasifikasi

Tabel periodik memiliki beberapa klasifikasi, antara lain sebagai berikut.
1. Sifat-sifat umum
Unsur-unsur kimia secara umum memiliki sifat fisika dan kimia yang terdiri dari tiga kategori, yaitu logam, metalloid, dan nonlogam.
Logam merupakan padatan yang berkilau dengan konduktivitas tinggi dan dapat membentuk alloy dengan bentuk logam lainnya. Karakteristik logam antara lain:
- Unsur logam ditempatkan pada sisi kiri tabel periodik
- 78% dari semua unsur yang dikenal adalah logam
- Bersifat padat pada suhu kamar dan memiliki titik leleh dan titik didih yang tinggi
- Mampu menghantarkan panas dan listrik dengan baik
- Dapat ditempa dan diregangkan
Nonlogam merupakan gas berwarna atau tidak berwarna yang bisa membentuk senyawa dengan bentuk non logam lain secara kovalen. Karakteristik nonlogam antara lain.
- Terletak pada sisi kanan atas tabel periodik
- Terdapat 22 unsur non-logam
- Biasanya berbentuk padatan atau gas pada suhu kamar
- Memiliki titik leleh dan titik didih yang rendah
- Penghantar panas dan listrik yang buruk
Metaloid adalah unsur yang biasanya bersifat di antara logam dan nonlogam ataupun cempuran dari keduanya. Klasifikasi pada tabel periodik biasanya ditunjukkan dengan warna tabel yang berbeda-beda untuk membatasi unsur logam dan nonlogam. Keduanya selanjutnya diklasifikasikan dalam subkategori dengan gradasi sifat dari logam ke nonlogam pada unsur kimia dalam periode yang sama.
2. Keadaan materi
Klasifikasi unsur-unsur kimia juga dibedakan berdasarkan wujud materi atau fase unsur. Seperti cair, padat, atau gas dalam temperatur dan tekanan standar (STP). Unsur yang berwujud padat biasanya memiliki temperatur konvensional dan tekanan atmosfer berwujud gas. Sedangkan unsur yang berwujud cair biasanya memiliki tekanan atmosfer normal dan memiliki temperatur pada 0 ◦C atau sekitar 32 ◦F seperti yang dimiliki oleh brom dan raksa.
3. Titik lebur dan titik didih
Digunakan untuk mendefinisikan karakter unsur yang dinyatakan dengan derajat celcius pada tekanan atmosfer tertentu. Klasifikasi unsur berdasarkan titik lebur dan titik didih sebenarnya sudah diketahui, namun pada beberapa unsur radioaktif dengan jumlah sangat kecil belum diketahui.
4. Massa jenis
Klasifikasi juga dapat menggunakan massa jenis pada temperatur dan tekanan standar (STP) sebagai karakter dari suatu unsur kimia. Massa jenis dinyatakan dalam gram per sentimeter kubik atau g/cm3 dan biasanya dinyatakan untuk unsur berwujud gas pada temperatur pengukuran wujud tertentu. Misalnya saat dicairkan atau dipadatkan, maka unsur gas memiliki massa jenis yang sama dengan unsur kimia lainnya.
5. Struktur kristal
Unsur kimia yang diteliti sampai saat ini memiliki delapan jenis struktur kristal dalam materialnya, yakni kubik, kubik pusat badan, kubus pusat muka, heksagonal, monokinis, ortorombik, rhombohedral, dan tetragonal.
6. Asal usulnya di Bumi
Terdapat 94 unsur yang terbentuk secara alami dan 24 unsur lain yang terbentuk secara artifisial sebagai produk sintesis melalui reaksi nuklir buatan. 83 unsur kimia dianggap primordian memiliki sifat stabil atau radioaktif yang lemah. Sementara 11 unsur sisanya dianggap sebagai unsur fanal karena memiliki waktu paruh yang singkat untuk berada di awal tata surya.
BACA JUGA: 6 Sifat Benda Padat dengan Pengertian, Ciri & Contohnya
Keterangan tabel periodik
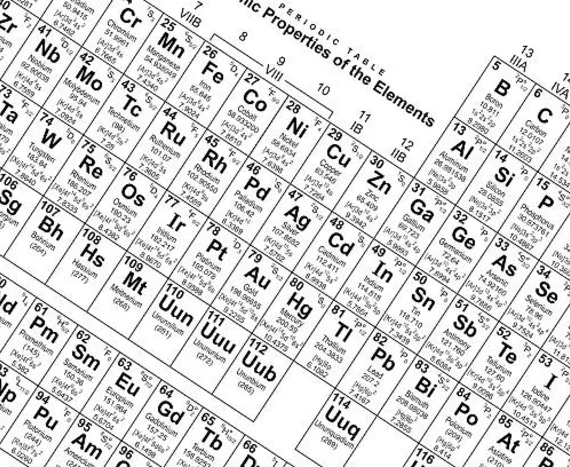
Berikut adalah keterangan yang terdapat pada tabel periodik.
- Tabel memiliki baris yang menunjukan periode dan kolom yang menunjukan golongan dari unsur-unsur kimia.
- Tabel unsur-unsur kimia dapat digunakan untuk menurunkan hubungan antara sifat-sifat unsur dan memprediksi sifat unsur baru yang akan ditemukan.
- Tabel ini menginformasikan kerangka kerja untuk melakukan analisis dari perilaku unsur kimia tertentu dalam bidang kajian ilmu kimia.
- Tabel ini memiliki golongan dengan nama selain nomor. Misalnya pada unsur golongan VII adalah halogen dan golongan VIII adalah gas mulia.
Unsur

Berikut adalah unsur-unsur yang terdapat dalam tabel periodik.
1. Periode merupakan bagian baris horizontal pada tabel.
2. Golongan adalah bagian berbentuk kolom vertikal dengan trend periodik, bukan menggunakan golongan periode dan blok tertentu.
3. Blok-s adalah unsur dari dua golongan, yaitu logam alkali dan alkali tanah. Blok ini juga berisi unsur tambahan berupa Hidrogen dan Helium.
4. Blok-p merupakan blok yang terdiri dari enam golongan, yaitu golongan 3 sampai 8 sesuai dengan ketentuan IUPAC mulai dari 3A hingga 8A. Blok ini memiliki kandungan yang sebagian besarnya adalah metaloid.
5. Blok-d ialah blok yang terdiri dari golongan 2B dan 3B dalam sistem penggolongan Amerika. Semua unsur kimia dalam golongan blok-d merupakan logam transisi.
6. Blok-f sering diletakkan pada bagian bawah. Golongan blok-f tidak memiliki nomor golongan yang terdiri dari lantanida dan aktinida.
BACA JUGA: Fungsi Pasir Zeolit dan Sifatnya untuk Kehidupan Sehari-hari
Sifat

Beberapa sifat yang dapat Sedulur pahami mengenai tabel periodik adalah sebagai berikut.
1. Jari-jari atom
Merupakan jarak dari inti atom sampai kulit terluar suatu atom. Secara periodik, jari-jari atom akan semakin besar dari atas ke bawah dalam satu golongan karena bertambahnya nomor atom beserta kulit elektron. Namun, jari-jari atom akan semakin kecil dari kiri ke kanan dalam satu periode.
2. Energi ionisasi
Merupakan energi untuk melepaskan elektron yang terikat paling lemah oleh suatu atom atau ion dalam wujud gas. Dalam satu golongan dari atas ke bawah, energi ionisasi akan semakin kecil. Sedangkan dalam satu periode dari kiri ke kanan, energi ionisasi akan cenderung bertambah. Energi ionisasi ini bergantung pada elektron yang akan dilepaskan, yakni besar gaya tarik inti terhadap elektron kulit terluar.
3. Afinitas elektron
Merupakan besarnya energi yang dihasilkan atau dilepaskan pada suatu atom yang menarik sebuah elektron. Dalam satu golongan dari atas ke bawah, afinitas elektron akan cenderung berkurang atau semakin kecil. Sementara dalam satu periode dari kiri ke kanan sampai golongan VII A afinitas elektron akan cenderung bertambah atau semakin besar kecuali pada unsur alkali tanah dan gas mulia.
Semua unsur golongan utama mempunyai afinitas elektron yang bertanda negatif, yang mana unsur golongan terbesarnya dimiliki oleh golongan halogen. Semakin negatif nilai afinitas elektron, maka semakin besar pula kecenderungan atom atau ion untuk menerima elektron.
4. Elektronegativitas
Merupakan kecenderungan suatu atom untuk menarik pasangan elektron dalam membentuk ikatan. Unsur yang memiliki energi ionisasi dan afinitas elektron yang besar akan memiliki keelektronegatifan semakin besar. Dalam satu golongan dari atas ke bawah, elektronegativitas akan semakin kecil, sedangkan dalam satu periode dari kiri ke kanan elektronegativitas akan cenderung semakin besar.
5. Logam dan Nonlogam
Merupakan kecenderungan atom untuk melepas elektron dan membentuk ion bermuatan positif yang tergantung pada energi ionisasi. Sifat logam berkaitan dengan keelektropositifan dimana besar energi ionisasinya, maka sifat logamnya akan berkurang. Sementara itu, sifat non logam berkaitan dengan keelektronegatifan, yakni kecenderungan atom untuk menyerap elektron.
Kecenderungannya melepas atau menarik suatu elektron disebut dengan kereaktifan. Unsur logam yang paling reaktif adalah golongan IA. Sementara unsur nonlogam yang paling reaktif berada pada golongan VIIA, di mana golongan VIIIA atau gas mulia tidak reaktif.
Sifat ini dalam satu golongan dari atas ke bawah akan semakin kecil, sementara dalam satu periode dari kiri ke kanan akan semakin bertambah hingga golongan VIIA.
Cara membaca

Terdapat beberapa cara untuk membaca tabel periodik dengan mudah. Berikut adalah caranya.
- Membaca dari kiri atas ke kanan bawah
- Memahami golongan pada unsur kimia
- Mengenali golongan atom dengan sifat fisik yang sama
- Memperhatikan ruang kosong pada tabel
- Memperhatikan periode suatu unsur kimia
- Membedakan antara unsur logam, semi logam, dan nonlogam
Sekian informasi mengenai tabel periodik beserta sejarah, klasifikasi, unsur, dan sifatnya. Semoga artikel ini dapat membantu Sedulur dalam belajar ilmu kimia lebih baik lagi dan meningkatkan semangat dalam mempelajari hal baru. Selamat belajar, ya!
Mau belanja bulanan nggak pakai ribet? Aplikasi Super solusinya! Mulai dari sembako hingga kebutuhan rumah tangga tersedia lengkap. Selain harganya murah, Sedulur juga bisa merasakan kemudahan belanja lewat handphone. Nggak perlu keluar rumah, belanjaan pun langsung diantar.
Bagi Sedulur yang punya toko kelontong atau warung, bisa juga lho belanja grosir atau kulakan lewat Aplikasi Super. Harga dijamin lebih murah dan bikin untung makin melimpah.



