Tahukah Sedulur apa itu termokimia? Salah satu ilmu kimia yang mempelajari hubungan antara kalor atau energi panas dengan reaksi kimia atau proses-proses yang berhubungan dengan reaksi kimia, itulah yang disebut sebagai termokimia.
Salah satu indikasi adanya proses kimia dalam kehidupan adalah ditemukannya pelepasan dan penyerapan kalor. Selain itu, termokimia juga lebih banyak berhubungan dengan pengukuran kalori yang menyertai reaksi kimia ataupun proses-proses yang berhubungan dengan perubahan struktur suatu zat.
Ingin tahu lebih lanjut tentang apa itu termokimia? Simak artikel berikut ini, yuk!
BACA JUGA: Hukum Kekekalan Energi: Definisi, Jenis, Rumus & Contohnya
Apa itu termokimia?

Secara definisi, termokimia adalah cabang ilmu kimia yang mempelajari tentang hubungan antara kalor dengan reaksi kimia ataupun proses-proses yang berhubungan dengan reaksi kimia. Ilmu ini memiliki kriteria yang digunakan sebagai ketentuan dalam menentukan kemungkinan yang terjadi atau spontanitas dari sebuah perubahan yang dibutuhkan.
Melalui cabang ilmu ini, Sedulur bisa memperkirakan adanya perubahan energi yang terjadi dalam suatu reaksi kimia, perubahan fase, dan pembentukan larutan. Selain itu, sebagian besar ciri-ciri dalam cabang ilmu ini juga merupakan perkembangan dari penerapan hukum I termodinamika dan hukum kekekalan energi, untuk fungsi energi dalam, entalpi, entropi, dan energi bebas Gibbs.
Lalu, apakah termokimia memiliki hubungan dengan termodinamika? Ya benar. Keduanya memiliki hubungan yang dekat karena termokimia menerapkan hukum pertama termodinamika, yakni hukum universal dari kekekalan energi dan perpindahan kalor.
Ciri-ciri termokimia

Telah disebutkan sebelumnya bahwa ciri-ciri termokimia merupakan perkembangan hukum I termodinamika dan hukum kekekalan energi, untuk fungsi energi dalam, entalpi, entropi, dan energi bebas Gibbs. Nah, berikut adalah beberapa ciri-ciri dalam termokimia yang bisa Sedulur pelajari.
1. Energi
Energi merupakan suatu kemampuan yang digunakan untuk melakukan suatu pekerjaan. Energi dimiliki oleh setiap benda dalam bentuk energi kinetik dan energi potensial. Benda-benda yang bergerak akan memiliki energi kinetik. Misalnya pada air terjun, kipas angin yang berputar, dan angin.
Sementara itu, energi potensial adalah energi yang dimiliki oleh benda karena keadaan atau kedudukannya. Misalnya pada energi pegas dan energi potensial gravitasi.
2. Kalor
Ciri berikutnya adalah kalor, yakni energi yang berpindah dari satu benda ke benda lain karena adanya perbedaan temperatur. Kalor memiliki satuan yang sama dengan energi, yaitu Joule (J). Meskipun begitu, kalor juga sering dinyatakan dengan satuan kalori atau kilokalori. Dalam suatu reaksi kimia, keberadaan kalor yang menyertai disebut sebagai kalor reaksi.
3. Sistem dan Lingkungan
Dalam termokimia, dua hal penting yang harus diperhatikan mengenai perpindahan energi adalah sistem dan lingkungan. Sistem adalah segala sesuatu yang menjadi pusat perhatian dalam mempelajari perubahan energi dan berubah selama proses berlangsung.
Sementara itu, lingkungan adalah suatu hal yang tidak berubah selama proses berlangsung dan yang membatasi sistem. Lingkungan ini juga bisa mempengaruhi sistem. Misalnya pada proses pelarutan air dengan garam. Sistemnya adalah air dan garam dapur. Sedangkan lingkungannya bisa jadi udara di sekitar.
BACA JUGA: Sel Volta: Pengertian, Rumus, Prinsip, Rangkaian & Contohnya
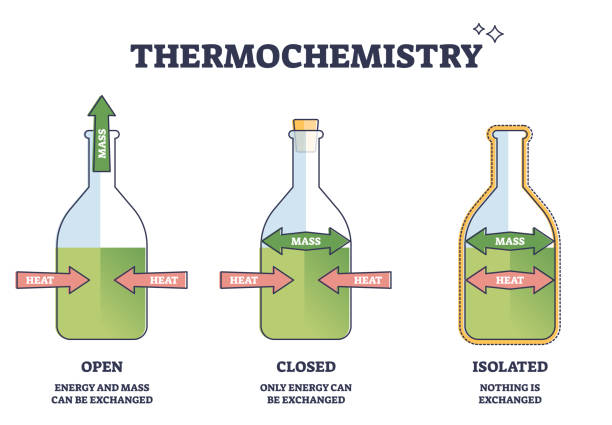
Berdasarkan interaksinya dengan lingkungan, sistem dibagi menjadi tiga jenis, yakni:
- Sistem terbuka, yaitu sistem yang memungkinkan adanya pertukaran energi dan materi di antara sistem dan lingkungan. Misalnya, melarutkan garam dapur di beker gelas yang terbuka.
- Sistem tertutup, yaitu sistem yang memungkinkan adanya pertukaran energi di antara sistem dan lingkungan, namun tidak memungkinkan terjadinya pertukaran materi. Misalnya, perubahan panas pada reaksi pelarutan di gelas beker yang tertutup. Pada keadaan ini, materi tidak akan keluar atau masuk di gelas beker karena kondisi yang tertutup. Namun, energi masih bisa keluar masuk gelas yang ditandai dengan adanya panas di dinding gelas beker ataupun aliran panas dari nyala api di luar gelas.
- Sistem terisolasi, yaitu sistem yang tidak memungkinkan adanya pertukaran energi dan materi di antara sistem dan lingkungan karena adanya batas yang mengisolasi sistem dan lingkungan. Misalnya pada air dalam termos. Hal ini karena air panas di dalam termos tidak mengalami perubahan suhu atau volume. Sehingga benda ataupun energi tidak mengalami perubahan.
Reaksi dalam termokimia
Dalam termokimia, ada dua jenis reaksi penting yang perlu diketahui, yaitu reaksi endoterm dan reaksi eksoterm. Berikut adalah penjelasannya.
Reaksi Endoterm
Reaksi endoterm merupakan suatu reaksi kimia yang memungkinkan terjadinya perpindahan kalor dari lingkungan ke sistem. Reaksi ini membutuhkan panas, menyerap panas, ataupun berupa reaksi pemutusan ikatan. Pada reaksi ini, harga ΔH = ( + ) sementara harga kalor pembentukannya = ( – ).
Perhatikan contoh berikut.
CaCO3(s) → CaO(s) + CO2(g) -178.5 kJ ; ΔH = +178.5 kJ.
Dari reaksi di atas dapat dilihat bahwa kalor pembentukannya = – 178.5 kJ, ΔH (perubahan entalpi) = +178.5 kJ.
Reaksi Eksoterm
Reaksi eksoterm merupakan suatu reaksi kimia yang memungkinkan terjadinya perpindahan kalor dari sistem ke lingkungan. Reaksi ini yang mengeluarkan, memberikan atau menghasilkan panas, dan bisa juga berupa reaksi pembentukan ikatan. Pada reaksi ini, harga ΔH ( – ) sementara harga kalor pembentukannya ( + ). Perlu diketahui bahwa reaksi eksoterm tidak stabil pada suhu tinggi.
Perhatikan contoh berikut.
C(s) + O2(g) → CO2(g) + 393.5 kJ; ΔH = -393,5 kJ.
Dari reaksi di atas dapat dilihat bahwa kalor pembentukannya = +393.5 kJ, ΔH (perubahan entalpi) = -393.5 kJ
Tabel 1. Perbedaan Reaksi Endoterm dan Reaksi Eksoterm
|
Reaksi Eksoterm |
Reaksi Endoterm |
|
Menghasilkan energi |
Memerlukan energi |
|
Sistem melepas kalor |
Sistem menyerap kalor |
|
Kalor berpindah dari sistem ke lingkungan |
Kalor berpindah dari lingkungan ke sistem |
|
Suhu naik |
Suhu turun |
|
∆H akhir < ∆H awal |
∆H akhir > ∆H awal |
|
∆H negative |
∆H positif |
BACA JUGA: Molalitas: Pengertian, Rumus, Satuan dan Contoh Soalnya
Penerapan termokimia

Setelah mengetahui apa itu termokimia beserta ciri-ciri dan jenis reaksinya, berikut adalah penjelasan mengenai penerapan ilmu termokimia dalam kehidupan sehari-hari.
1. Kromatografi lapis tipis
Penerapan termokimia dapat dilihat pada proses pengembangan noda ketika melakukan kromatografi lapis tipis. Dalam hal ini, noda akan berpendar pada tempat yang terpapar sinar ultraviolet ketika dipanaskan pada suhu tinggi.
Reaksi larutan juga dapat dideteksi melalui pemisahan pada silika gel dengan ikatan aminopropil. Dalam hal ini, permukaan lempeng silika gel akan bertindak sebagai katalis yang melakukan konjugasi dengan senyawa π- elektron yang melimpah. Reaksi ini juga akan membentuk produk yang mengalami fluoresensi jika sudah berada dalam kondisi jenuh.
2. Pembuatan bahan bakar minyak atau gas
Penerapan berikutnya adalah dalam pembuatan bahan bakar minyak dan gas yang menggunakan bahan baku dari mikroalga. Cara pembuatan bahan bakar minyak dan gas ini melalui beberapa tahapan, yakni gasifikasi, pirolisis, hidrogenasi dan likuifaksi.
3. Gasifikasi
Gasifikasi adalah proses pengubahan biomassa menjadi bahan bakar gas atau bahan kimia. Proses ini menggunakan bahan dasar karbon yang diubah melalui proses termokimia menggunakan suhu standar, yakni antara 600–1.000 derajat Celcius.
Proses oksidasi dalam gasifier akan dilakukan dengan bantuan media udara, oksigen, uap air, maupun gabungan antara ketiganya. Bahan baku yang digunakan ketika melakukan gasifikasi dengan termokimia adalah biomassa lignoselulosa yang sudah dikeringkan dan digiling dengan ukuran tertentu.
4. Pembuatan bioetanol
Ilmu kimia ini juga dapat diterapkan dalam pembuatan bioetanol dengan bahan baku berupa biomassa lignoselulosa. Pencampuran antara gas karbon monoksida dengan dua atom hidrogen akan menghasilkan etanol melalui reaksi eksotermis yang dihasilkan pada tekanan 200 bar dengan bantuan katalis logam bersuhu 300 derajat Celcius.
Proses termokimia tersebut juga bisa menghasilkan produk sampingan berupa alkohol dalam bentuk butanol, propanol, dan methanol. Banyaknya hasil yang dihasilkan membuat proses termokimia dalam pembuatan bioetanol dinilai memiliki tingkat daya guna yang tinggi.
Contoh soal termokimia

Agar Sedulur lebih paham mengenai termokimia, berikut adalah contoh soal dan pembahasan yang bisa Sedulur pelajari.
1. Apa saja yang dipelajari dalam cabang ilmu kimia termokimia? Sebutkan!
Jawab:
Dalam ilmu termokimia, kita dapat mempelajari beberapa hal, yakni perubahan energi yang menyertai reaksi kimia, reaksi kimia yang berlangsung secara spontan, dan reaksi kimia dalam kedudukan kesetimbangan.
2. Suatu campuran pereaksi di dalam tabung reaksi menyebabkan tabung tersebut menjadi panas jika dipegang. Pernyataan yang tepat mengenai hal tersebut adalah….
a, Entalpi pereaksi berkurang
b. Entalpi pereaksi bertambah
c. Entalpi pereaksi dan hasil reaksi bertambah
d. Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
Jawab:
Jika suatu reaksi kimia menghasilkan panas, maka reaksi tersebut merupakan reaksi eksoterm. Pada reaksi eksoterm, entalpi reaksi bernilai negative (entalpi pereaksi lebih besar daripada entalpi hasil reaksi). Jadi jawabannya adalah d.
3. Sebuah Kristal KNO3 dimasukkan ke dalam tabung reaksi kemudian ditetesi dengan air. Pada tabung reaksi terasa dingin. Reaksi ini dapat digolongkan sebagai?
a. Eksoterm, energi berpindah dari sistem ke lingkungan
b. Eksoterm, energi berpindah dari lingkungan ke sistem
c. Endoterm, energi berpindah dari sistem ke lingkungan
d. Endoterm, energi berpindah dari lingkungan ke sistem
Jawab:
Pada percobaan tersebut reaksi yang terjadi adalah endoterm, karena pada saat KNO3 bereaksi dengan air, temperature akan turun karena tabung reaksi terasa dingin. Setelah sampai pada titik terendah, lama-kelamaan temperature akan naik kembali sampai temperature awal. Penurunan temperature pada saat KNO3 bereaksi dengan air inilah yang menunjukkan bahwa reaksi menyerap kalor. Jadi, jawabannya adalah d.
Demikian informasi mengenai apa itu termokimia beserta contoh soal dan pembahasannya. Semoga informasi ini dapat bermanfaat dan semakin menambah wawasan Sedulur dalam mempelajari ilmu kimia. Selamat belajar!
Mau belanja bulanan nggak pakai ribet? Aplikasi Super solusinya! Mulai dari sembako hingga kebutuhan rumah tangga tersedia lengkap. Selain harganya murah, Sedulur juga bisa merasakan kemudahan belanja lewat handphone. Nggak perlu keluar rumah, belanjaan pun langsung diantar.
Bagi Sedulur yang punya toko kelontong atau warung, bisa juga lho belanja grosir atau kulakan lewat Aplikasi Super. Harga dijamin lebih murah dan bikin untung makin melimpah.



