Elektrokimia merupakan salah satu cabang ilmu kimia yang mempelajari aspek elektronik dari reaksi kimia. Salah satu yang termasuk sel elektrokimia adalah sel volta. Sel ini merupakan sel yang dapat mengubah reaksi kimia dari reaksi redoks spontan.
Reaksi redoks spontan dapat diubah dan digunakan untuk sumber listrik. Dengan kata lain, sel volta merupakan sel elektrokimia yang bisa menghasilkan energi listrik secara spontan dari reaksi kimia yang terjadi di dalam larutan.
Wah menarik sekali pembahasannya, ya. Jika Sedulur tertarik untuk belajar lebih jauh, simak informasi berikut ini, yuk!
BACA JUGA: Molalitas: Pengertian, Rumus, Satuan dan Contoh Soalnya
Pengertian sel volta

Secara sederhana, sel volta adalah sel elektrokimia yang dapat mengubah energi kimia menjadi energi listrik. Energi listrik tersebut dapat muncul karena adanya pergerakan elektron sebab reaksi redoks spontan, yaitu reduksi oksidasi.
Sel volta juga sering disebut sebagai sel galvani. Sebutan ini muncul karena pencetus sel ini adalah seorang ilmuwan bernama Alessandro Volta (1745-1827) dan Luigi Galvani (1737-1798). Mereka berdua merupakan seorang ahli fisiologi dari Italia.
Awalnya, Galvani memiliki ide untuk membuktikan sifat listrik pada tulang hewan melalui percobaan pada tulang katak. Selanjutnya, ide tersebut direspons oleh Volta yang menyatakan bahwa listrik bisa muncul karena adanya kontak antara logam yang berbeda. Karena ide itulah, ditemukan sel volta yang sangat bermanfaat hingga saat ini.
Rumus sel volta
Sebelum membahas rumus, Sedulur perlu mengetahui bahwa reaksi pada sel volta dituliskan dalam bentuk notasi sel, yakni A|Ax+||Ky+|K. Notasi huruf A merupakan reaksi yang terjadi pada anoda, sedangkan notasi huruf K merupakan reaksi yang terjadi pada katoda.
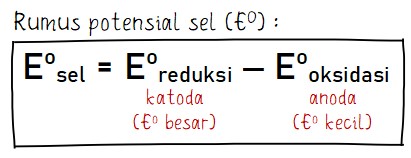
Nah, untuk mengetahui nilai potensial sel standar, perhatikan rumus berikut ini.
E⁰ sel = E⁰ katoda – E⁰ anoda
Sebagai catatan penting, potensial sel standar (E⁰ sel) harus memiliki nilai positif agar reaksi yang terjadi bisa berjalan spontan. Dengan begitu, nilai E⁰ anoda haruslah lebih kecil dari E⁰ katoda.
Prinsip sel volta
Secara prinsip kerja, sel volta akan bekerja dengan pemisahan dua bagian reaksi redoks, yakni setengah reaksi oksidasi di anoda dan setengah reaksi reduksi di katoda. Prinsip-prinsip yang perlu diperhatikan dalam rangkaian sel volta antara lain, yaitu:
- Energi kimia akan diubah menjadi energi listrik.
- Anoda merupakan tempat terjadinya reaksi oksidasi, sedangkan katoda merupakan tempat terjadinya reaksi reduksi.
- Anoda adalah kutub negatif, sementara katoda adalah kutub positif.
- Prinsip kerjanya adalah elektron akan mengalir dari anoda menuju katoda.
BACA JUGA: Campuran Heterogen adalah: Pengertian dan Contohnya
Rangkaian
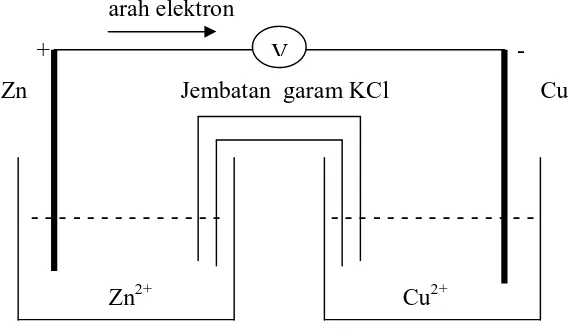
Dalam mempelajari sel ini, Sedulur juga harus paham mengenai rangkaian yang ada. Ada empat komponen yang menyusun rangkaian sel volta, yakni:
- Voltmeter, berfungsi untuk menentukan besar energi potensial.
- Jembatan garam, berfungsi untuk menjaga keseimbangan jumlah kation dan anion dalam larutan.
- Anoda (elektroda negatif), berupa seng (Zn) yang menjadi tempat terjadinya reaksi oksidasi.
- Katoda (elektroda positif), berupa tembaga (Cu) yang menjadi tempat terjadinya reaksi reduksi.
Dari komponen di atas, rangkaian sel volta akan tersusun menjadi 2 buah sel (masing-masing hanya setengah) yang dihubungkan dengan jembatan garam. Setengah sel tersebut akan terdiri dari elektroda (logam) dan elektrolitnya. Dalam rangkaian ini, jembatan garam akan berperan sebagai penyeimbang muatan antar sel yang terbuat dari pipa berisi gel elektrolit.
Dua buah elektroda yang terpasang dan disambungkan dengan voltmeter pada rangkaian berfungsi untuk mengukur beda potensial yang ada. Mengapa demikian? Hal ini karena beda potensial merupakan perbedaan jumlah elektron pada suatu arus listrik, sehingga pada katoda dan anoda yang digunakan akan memiliki nilai yang berbeda.
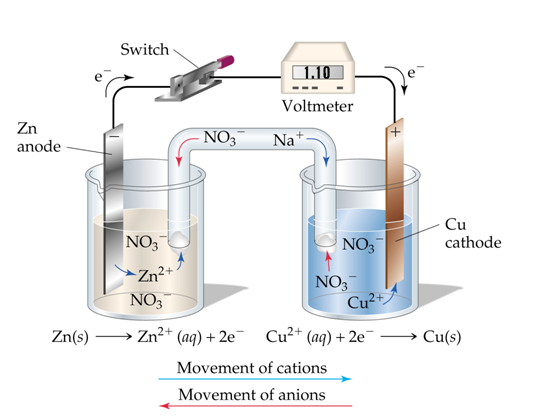
Sebagai contoh, rangkaian sel volta biasanya menggunakan logam Zn dan Cu. Ketika rangkaian ditutup, maka kedua logam akan bereaksi secara spontan dan akhirnya menghasilkan arus listrik.
Logam Zn akan teroksidasi menjadi Zn2+ dan sel Cu akan tereduksi dari Cu2+ menjadi Cu. Dengan terjadinya hal ini, maka massa logam Zn akan berkurang dan massa logam Cu akan bertambah.
Reaksi yang terjadi tersebut menjelaskan bahwa logam Zn menghasilkan elektron yang mengalir menuju Cu2+. Oleh sebab itu, sel Zn merupakan elektroda negatif atau anoda dan Cu merupakan elektroda positif atau katoda.
Berikut adalah gambaran proses terjadinya reaksi, dimana elektron akan mengalir dari anoda ke katoda.
Anoda Zn(s) → Zn2 + (aq) + 2e katoda Cu2+(aq) + 2e- → Cu(s) reaksi sel Zn(s) +
Cu2 + (aq) → Zn 2+ (aq) + Cu(s) , E° sel = 1,10 Volt
Rangkaian sel volta di atas juga bisa dinyatakan sebagai notasi sel, sebagai berikut:
- Zn(s) / Zn2+(aq) = Reaksi di anoda
- Cu2+(aq) / Cu(s) = Reaksi di katoda
E° merupakan potensial elektroda yang dibandingkan dengan elektroda hidrogen (diukur pada suhu 25°C dan tekanan 1 atm). Potensial sel volta ini bisa Sedulur hitung dengan voltmeter atau menggunakan data dari potensial elektroda standar (E° reduksi). Perlu diketahui bahwa Unsur E° akan lebih besar pada reaksi reduksi di katoda, dan akan lebih kecil pada reaksi oksidasi di anoda.
Contoh dalam kehidupan sehari-hari

Lebih jelasnya, berikut adalah beberapa pemanfaatan sel volta dalam kehidupan sehari-hari. Simak ulasannya, ya!
- Baterai lithium (Li)
Baterai ponsel yang sebagian menggunakan lithium-ion merupakan salah satu contoh penerapan sel volta. Reaksi yang terjadi dapat dinotasikan sebagai:
Li|Li+|KOH (pasta)|MnO2,Mn(OH)3,C
- Akumulator (AKI)
AKI merupakan sumber arus listrik yang berisi larutan asam sulfat (H2SO4) dan logam timbal (Pb). Pada kondisi ini, logam timbal (Pb) bertindak sebagai anoda dan timbal oksida (PbO2) sebagai katoda. Sementara itu, asam sulfat (H2SO4) bertindak sebagai elektrolit.
Reaksi yang terjadi pada akumulator adalah:
Anoda: Pb (s) + SO42- (aq) → PbSO4 (s) + 2e–
Katoda: PbSO4 (s) + 4H+ (aq) + SO42- (aq) + 2e– → PbSO4 (aq) + 2H2O (l)
- Fuel cell
Fuell cell merupakan sumber energi cadangan yang dinilai ramah lingkungan. Cara kerja alat ini mirip dengan baterai, namun reaktan yang terkonsumsi bisa diisi ulang sehingga bisa digunakan berkali-kali.
Reaksi yang terjadi pada fuel cell adalah sebagai berikut.
Anoda: H2 (g) + 2OH– (aq) → 2H2O (l) + 2e–
Katoda: O2 (g) + 2H2O (l) + 4e– → 4OH– (aq)
Reaksi sel: O2 (g) + 2H2 (g) → 2H2O (l)
- Baterai Alkali
Contoh terakhir adalah baterai alkali. Baterai ini mengandung unsur alkali dan memiliki susunan yang berbeda dari baterai kering. Namun, reaksi redoks yang terjadi pada kedua baterai tersebut memiliki prinsip yang sama yaitu oksidasi logam seng (Zn) dan reduksi mangan dioksida (MnO2).
Akan tetapi, hasil dari reaksi pada baterai alkali akan memiliki perbedaan karena baterai ini melibatkan ion hidroksida dari pasta KOH dalam reaksinya. Sebagai contoh, baterai alkali biasa digunakan pada alat tape recorder dan camera.
BACA JUGA: Zat Tunggal: Pengertian, Ciri, & Bedanya dengan Zat Campuran
Contoh soal

Berikut adalah beberapa contoh soal untuk membantu Sedulur memahami pembahasan sel volta lebih baik lagi.
- Perubahan apakah yang terjadi pada sel volta?
- energi listrik menjadi energi kimia
- energi gerak menjadi energi listrik
- energi listrik menjadi energi panas
- energi listrik menjadi energi kinetik
- energi kimia menjadi energi listrik
Jawab:
Sel volta merupakan sel yang melakukan reaksi untuk merubah energi kimia (reaksi kimia) menjadi energi listrik (perbedaan potensial listrik) secara spontan. Jadi, jawabannya adalah E.
- Jika diketahui potensial reduksi standar beberapa logam adalah seperti berikut ini.
- Mg2+ + 2e– → Mg E0 = -2,35 V
- Ag+ + e– → Ag E0 = +0,79 V
- Cu2+ + 2e– → Cu E0 = +0,32 V
- Zn2+ + 2e– → Zn E0 = -0,78 V
- Fe2+ + 2e– → Fe E0 = -0,48 V
Manakah dari sel berikut yang merupakan sel volta?
- a) Mg|Mg2+||Cu2+|Cu
- b) Fe|Fe2+||Cu2+|Cu
- c) Ag|Ag+|| Cu2+|Cu
- d) Fe|Fe2+|| Ag+|Ag
- e) Mg|Mg2+||Fe2+|Fe
- f) Zn|Zn2+|| Fe2+|Fe
Jawab:
Dalam menjawab pertanyaan ini, Sedulur perlu mengingat bahwa syarat sel volta adalah reaksi spontan yang ditandai dengan potensial sel yang positif. Sesuai rumus berikut, E⁰ sel = E⁰ katoda – E⁰ anoda, maka potensial sel positif akan didapatkan jika E⁰ anoda < E⁰ katoda.
Notasi sel sebelah kiri adalah anoda sementara di sebelah kanan adalah katoda. Sebagai contoh pada Mg|Mg2+||Cu2+|Cu,
- Mg|Mg2+ adalah anoda, E⁰ = -2,35 V
- Cu2+|Cu adalah katoda E⁰ = +0,32 V
Karena E⁰ anoda (Mg) < dari E⁰ katoda (Cu), maka sel Mg|Mg2+||Cu2+|Cu merupakan sel volta. Cara lain yang bisa digunakan adalah melihat apakah setengah sel kiri memiliki E⁰ lebih kecil.
Dengan demikian, maka yang termasuk sel volta adalah (a), (b), (d), dan (e).
Demikian informasi mengenai sel volta beserta rumus, prinsip, rangkaian, dan contohnya. Semoga informasi ini dapat bermanfaat bagi Sedulur semua, ya. Selamat belajar!
Mau belanja bulanan nggak pakai ribet? Aplikasi Super solusinya! Mulai dari sembako hingga kebutuhan rumah tangga tersedia lengkap. Selain harganya murah, Sedulur juga bisa merasakan kemudahan belanja lewat handphone. Nggak perlu keluar rumah, belanjaan pun langsung diantar.
Bagi Sedulur yang punya toko kelontong atau warung, bisa juga lho belanja grosir atau kulakan lewat Aplikasi Super. Harga dijamin lebih murah dan bikin untung makin melimpah.



