Konfigurasi elektron merupakan salah satu materi dalam pelajaran Kimia yang mempelajari susunan elektron berdasarkan kulit atau orbital dari suatu atom. Materi ini menjelaskan bagaimana elektron didistribusikan dalam orbital atomnya.
Elektron adalah partikel subatom yang stabil dengan muatan listrik negatif yang ditemukan di semua atom dan bertindak sebagai pembawa utama listrik dalam padatan. Istilah ini ditemukan oleh G. Johnstone Stoney pada 1891. Simak informasi berikut untuk mempelajari lebih lanjut mengenai elektron dan cara menentukan konfigurasinya, ya, Sedulur!
BACA JUGA: Hibernasi: Pengertian, Proses dan Contoh Hewannya
1. Pengertian
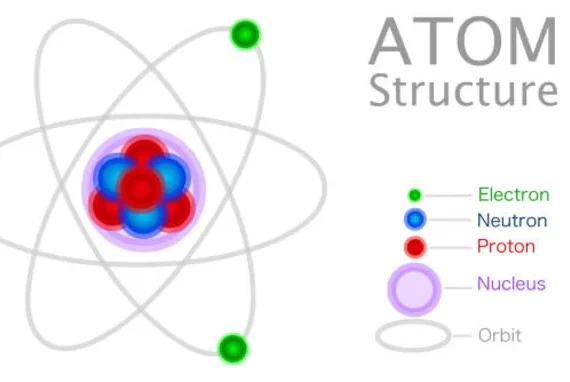
Elektron merupakan partikel subatom yang memiliki muatan dasar sebesar -1. Muatan elektron ini sama besarnya dengan muatan yang dipegang oleh proton tetapi memiliki tanda yang berlawanan. Konfigurasi elektron (KE) juga disebut sebagai struktur elektron, merupakan susunan elektron dalam tingkat energi di sekitar inti atom.
KE suatu atom mengikuti notasi standar, yang mana semua subkulit atom yang mengandung elektron ditempatkan secara berurutan. Simbol yang digunakan untuk menulis konfigurasi ini dimulai dengan nomor kulit (n) dan diikuti dengan jenis orbital serta superscript yang menunjukkan jumlah elektron dalam orbital.
2. Fungsi
Konfigurasi dalam elektron memiliki fungsi untuk:
- Menentukan valensi suatu unsur
- Memprediksi sifat sekelompok elemen, seperti elemen dengan konfigurasi elektron yang sama cenderung menunjukkan sifat serupa
- Menafsirkan spektrum atom
BACA JUGA: Hukum Hooke: Pengertian, Bunyi, Aplikasi, Rumus & Contohnya
3. Tabel dan urutan konfigurasi
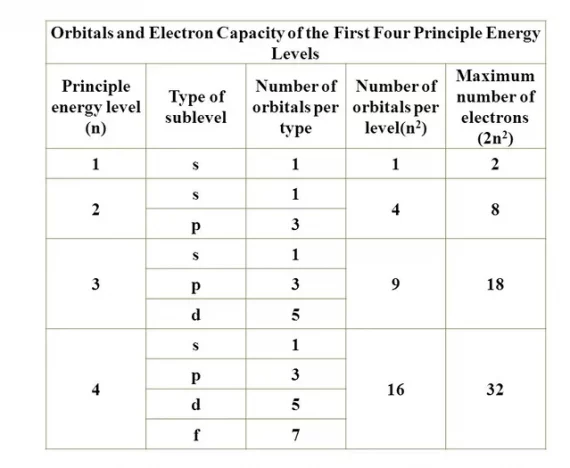
Ada dua cara yang digunakan dalam menentukan konfigurasi pada elektron, yaitu cara per kulit (konfigurasi elektron k l m n) dan cara per subkulit (elektron konfigurasi s p d f). Cara per kulit hanya digunakan untuk atom unsur pada golongan utama (golongan A). Sementara cara per subkulit digunakan untuk atom-atom unsur pada golongan transisi (golongan B).
Seperti dapat dilihat pada tabel konfigurasi elektron di atas, jumlah elektron yang dapat ditempati oleh setiap kulit yaitu, kulit pertama (kulit K) sebesar 2 elektron, konfigurasi elektron l (kulit L) sebesar 8 elektron, kulit ketiga (kulit M) sebesar 18 elektron, dan kulit keempat (kulit N) sebesar 32 elektron.
Sementara itu, urutan konfigurasi elektron juga dapat ditentukan dengan cara per subkulit dengan urutan s p d f. Urutan ini akan dijelaskan lebih lanjut pada bagian selanjutnya.
4. Cara menentukan konfigurasi elektron

Untuk menentukan konfigurasi elektron yang benar adalah dengan mengikuti aturan yang ada. Berikut beberapa aturan elektron konfigurasi pada suatu unsur.
1. Prinsip Aufbau
Prinsip ini dinamai menurut kata Jerman ‘Aufbeen’ yang berarti ‘membangun’. Prinsip Aufbau menyatakan bahwa elektron akan menempati orbital yang memiliki energi lebih rendah sebelum menempati orbital yang memiliki energi lebih tinggi.
Energi suatu orbital akan dihitung dengan jumlah bilangan kuantum utama dan bilangan kuantum azimut. Menurut prinsip ini, elektron akan diisi dengan urutan sebagai berikut:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p dan seterusnya.
Akan tetapi, ada pengecualian pada prinsip Aufbau seperti untuk kromium dan tembaga. Pengecualian ini terkadang dapat dijelaskan oleh stabilitas yang diberikan oleh subkulit yang terisi setengah atau terisi penuh.
2. Asas pengecualian Pauli
Asas pengecualian Pauli menyatakan bahwa dua elektron maksimum masing-masing memiliki spin yang berlawanan dan dapat masuk dalam orbital. Prinsip ini juga dapat dinyatakan sebagai “tidak ada dua elektron dalam atom yang sama yang memiliki nilai yang sama untuk keempat bilangan kuantum”.
Oleh karena itu, jika bilangan pokok, azimut, dan magnetik sama untuk dua elektron. Keduanya harus memiliki spin yang berlawanan.
3. Aturan Hund
Aturan ini menjelaskan mengenai urutan pengisian elektron di semua orbital yang termasuk dalam subkulit. Aturan ini menyatakan bahwa setiap orbital dalam subkulit tertentu ditempati secara tunggal oleh elektron sebelum elektron kedua diisi dalam orbital.
Untuk memaksimalkan spin total, elektron dalam orbital yang hanya berisi satu elektron semuanya akan memiliki spin yang sama atau nilai bilangan kuantum spin yang sama.
BACA JUGA: Pengertian Senyawa Beserta Jenis dan Contohnya
5. Contoh
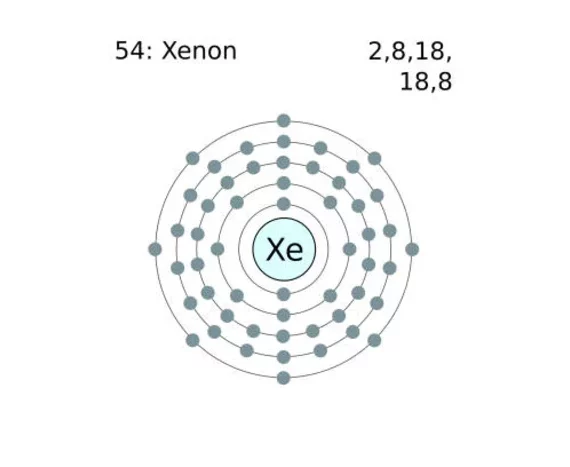
Berikut adalah contoh konfigurasi elektron pada beberapa atom.
1. Hidrogen. Nomor atom hidrogen adalah 1 sehingga mengandung 1 elektron. Elektron ini nantinya akan ditempatkan pada subkulit s pada kulit atau orbit pertama K. Sehingga KE hidrogen dapat ditulis sebagai 1s1.
2. Oksigen. Nomor atom oksigen adalah 8 sehingga mengandung 8 elektron. Elektron diisi dengan urutan sebagai berikut:
- Kulit K – 2 elektron
- Kulit L – 6 elektron
Sehingga KE oksigen dapat ditulis sebagai 1s2 2s2 2p4.
3. Klorin memiliki nomor atom 17. Oleh karena itu, 17 elektronnya didistribusikan dengan cara berikut:
- Kulit K – 2 elektron
- Kulit L – 8 elektron
- Kulit M – 7 elektron
Konfigurasi elektron 17Cl dapat ditulis sebagai 1s22s22p63s23p5 atau [Ne]3s23p5.
Contoh lain adalah konfigurasi elektron Br yaitu [Ar] 4s² 3d¹⁰ 4p⁵.
Sekian informasi mengenai konfigurasi elektron beserta contoh dan cara menentukannya. Semoga informasi berikut dapat membantu Sedulur dalam mempelajari pelajaran kimia dengan baik. Selamat belajar!
Mau belanja bulanan nggak pakai ribet? Aplikasi Super solusinya! Mulai dari sembako hingga kebutuhan rumah tangga tersedia lengkap. Selain harganya murah, Sedulur juga bisa merasakan kemudahan belanja lewat handphone. Nggak perlu keluar rumah, belanjaan pun langsung diantar. Yuk, unduh aplikasinya di sini sekarang!
Bagi Sedulur yang punya toko kelontong atau warung, bisa juga lho belanja grosir atau kulakan lewat Aplikasi Super. Harga dijamin lebih murah dan bikin untung makin melimpah. Langsung restok isi tokomu di sini aja!



